Seiteninhalt
Allgemeine Beschreibung der Proteinnutzung im Körper
Proteine sind essenzielle Moleküle, die in nahezu allen biologischen Prozessen eine Rolle spielen. Sie sind die Bausteine des Lebens und werden in jeder Zelle des Körpers eingesetzt, um verschiedene Strukturen aufzubauen, Funktionen auszuführen und biochemische Reaktionen zu katalysieren. Proteine können strukturell wirken, als Enzyme Reaktionen beschleunigen, Transportfunktionen übernehmen oder als Signalmoleküle dienen.
Proteine übernimmt der Körper für strukturgebende Aufgaben wie die Bildung von Geweben und Organen. Zudem spielen sie eine wichtige Rolle bei funktionalen Prozessen wie der Signalübertragung, dem Molekültransport und der Abwehr von Krankheitserregern.
Konkrete Beispiele für den Einsatz von Proteinen im Körper
Strukturproteine: Kollagen
Kollagen ist das am häufigsten vorkommende Protein im menschlichen Körper und ein Hauptbestandteil von Haut, Knochen, Sehnen und Bändern. Es verleiht Geweben ihre Festigkeit und Elastizität, indem es eine stabile Gerüststruktur bildet. Kollagen wird kontinuierlich abgebaut und erneuert, insbesondere in Geweben, die hohen mechanischen Belastungen ausgesetzt sind.
Enzyme: Amylase
Enzyme sind spezielle Proteine, die biochemische Reaktionen beschleunigen, ohne selbst verbraucht zu werden. Ein Beispiel ist Amylase, die im Speichel und der Bauchspeicheldrüse produziert wird. Sie spaltet komplexe Kohlenhydrate wie Stärke in kleinere Moleküle, wie Maltose oder Glukose, damit der Körper diese als Energiequelle nutzen kann.
Transportproteine: Hämoglobin
Hämoglobin, ein Protein in den roten Blutkörperchen, transportiert Sauerstoff aus der Lunge zu den Zellen im gesamten Körper und bringt Kohlendioxid zurück zur Lunge, wo es ausgeatmet wird. Ohne Hämoglobin könnte der Sauerstoff nicht effizient zu den Geweben gelangen, die ihn für die Energiegewinnung benötigen.
Zusammenfassung
Proteine sind vielseitig einsetzbare Moleküle, die in jeder Zelle und bei fast allen biologischen Prozessen benötigt werden. Von der Bereitstellung mechanischer Stabilität (Kollagen), über die Unterstützung chemischer Reaktionen (Amylase), bis hin zum Transport lebenswichtiger Moleküle (Hämoglobin) – Proteine sind essenziell für die Gesundheit und das Überleben.
Aminosäuren: Die Bausteine der Proteine
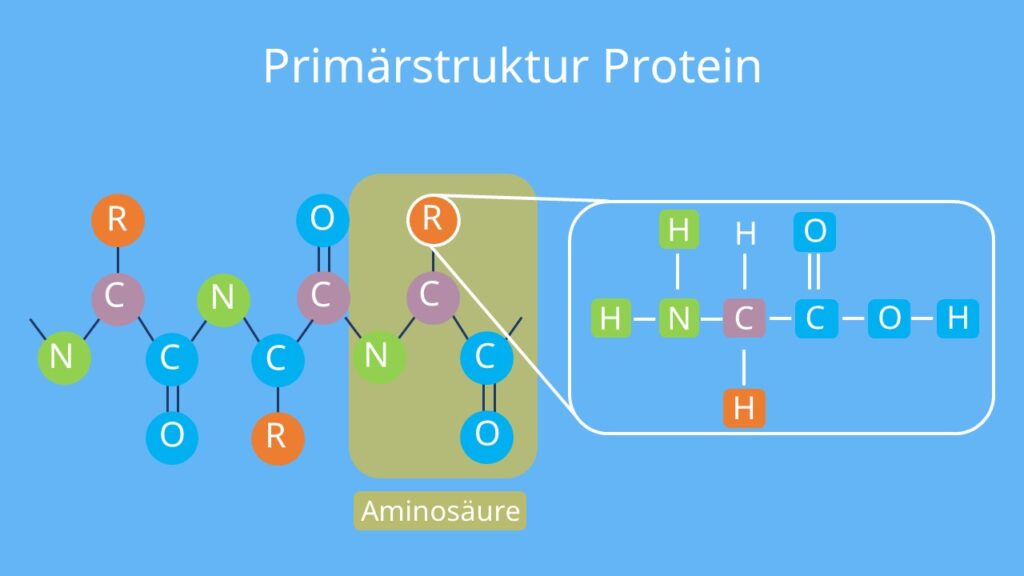
Proteine bestehen aus langen Ketten von Aminosäuren, die durch chemische Bindungen miteinander verknüpft sind. Aminosäuren sind organische Moleküle mit einer Grundstruktur, die aus einer Aminogruppe (-NH₂), einer Carboxylgruppe (-COOH), einem Wasserstoffatom (H) und einer variablen Seitenkette (R-Gruppe) besteht, die jede Aminosäure einzigartig macht. Es gibt 20 Standardaminosäuren, die für die Bildung von Proteinen genutzt werden.
Die Seitenkette (R-Gruppe) bestimmt die spezifischen chemischen Eigenschaften jeder Aminosäure, wie Polarität, Ladung und Größe, und spielt eine entscheidende Rolle bei der Faltung und Funktion des Proteins.
Bildung von Polypeptidketten: Die Primärstruktur
Eine lineare Sequenz von Aminosäuren, die durch Peptidbindungen miteinander verknüpft sind, bildet Proteine. Diese Bindungen entstehen durch eine Kondensationsreaktion, bei der die Carboxylgruppe einer Aminosäure mit der Aminogruppe einer anderen reagiert und dabei ein Molekül Wasser (H₂O) freisetzt.
Dieser Prozess wird durch Ribosomen während der Translation gesteuert, einem Schritt der Proteinbiosynthese. Die genetische Information in der DNA bestimmt die Reihenfolge der Aminosäuren, die sogenannte Primärstruktur des Proteins. Diese Sequenz ist entscheidend für die weiteren Strukturebenen und die Funktion des Proteins.
Sekundärstruktur: Lokale Faltungen
Nach der Bildung der Primärstruktur faltet sich die Polypeptidkette lokal zu regelmäßigen Mustern, die Wasserstoffbrücken zwischen den Atomen der Peptidbindungen stabilisieren. Zwei häufige Formen der Sekundärstruktur sind:
- α-Helix: Eine spiralförmige Struktur entsteht, die Wasserstoffbrücken zwischen einer Aminosäure und der vierten nachfolgenden Aminosäure stabilisieren.
- β-Faltblatt: Eine flache, gefaltete Struktur, die durch Wasserstoffbrücken zwischen parallel oder antiparallel angeordneten Kettenabschnitten entsteht.
Die Sekundärstruktur verleiht der Polypeptidkette Stabilität und eine erste Form.
Tertiärstruktur: Die dreidimensionale Faltung
Die Tertiärstruktur entsteht durch die Faltung der gesamten Polypeptidkette in eine dreidimensionale Form. Wechselwirkungen zwischen den R-Gruppen (Seitenketten) der Aminosäuren stabilisieren diese Struktur, einschließlich:
- Hydrophobe Wechselwirkungen: Unpolare Seitenketten lagern sich zusammen, um Kontakt mit Wasser zu vermeiden.
- Wasserstoffbrücken: Stabilisieren die Struktur durch Wechselwirkungen zwischen polaren Gruppen.
- Ionenbindungen: Entstehen zwischen positiv und negativ geladenen Seitenketten.
- Disulfidbrücken: Eine kovalente Bindung zwischen zwei Cystein-Aminosäuren, die die Struktur besonders stabil macht.
Die Tertiärstruktur bestimmt die endgültige Form des Proteins und ist für dessen Funktion entscheidend, wie die Bindung an andere Moleküle oder die katalytische Aktivität bei Enzymen.
Quartärstruktur: Komplexe Proteine
Bei manchen Proteinen setzt sich die endgültige Struktur aus mehreren Polypeptidketten (Untereinheiten) zusammen, die durch nicht-kovalente Wechselwirkungen oder Disulfidbrücken verbunden sind. Diese Zusammensetzung wird als Quartärstruktur bezeichnet. Ein Beispiel ist Hämoglobin, das aus vier Untereinheiten besteht und Sauerstoff transportiert.
Die Quartärstruktur ermöglicht komplexe Funktionen, wie die Zusammenarbeit verschiedener Untereinheiten bei der Bindung oder Freisetzung von Molekülen.
Funktionelle Vielfalt von Proteinen
Die dreidimensionale Struktur eines Proteins bestimmt seine Funktion, und diese Struktur hängt von der Aminosäuresequenz ab. Proteine erfüllen eine Vielzahl von Aufgaben im Körper:
- Enzyme: Katalysieren biochemische Reaktionen, wie die Verdauung von Nährstoffen.
- Strukturproteine: Bauen Gewebe wie Kollagen (in Haut und Knochen) und Keratin (in Haaren und Nägeln) auf.
- Transportproteine: Befördern Moleküle wie Sauerstoff (z. B. durch Hämoglobin).
- Signalproteine: Vermitteln Zellkommunikation, wie Hormone oder Neurotransmitter.
- Immunsystem: Antikörper erkennen und neutralisieren Krankheitserreger.
Die vielfältigen Aufgaben zeigen, wie essenziell die präzise Zusammensetzung und Faltung eines Proteins ist.
Zusammenspiel der Strukturebenen
Die Strukturebenen eines Proteins – Primär-, Sekundär-, Tertiär- und Quartärstruktur – wirken zusammen, um die Form und Funktion des Proteins zu bestimmen. Eine Störung in einer dieser Ebenen, beispielsweise durch Mutationen in der DNA, kann die Funktion des Proteins beeinträchtigen und zu Krankheiten führen.
Zusammenfassung
Aminosäuren verbinden sich durch Peptidbindungen zu Proteinen, wobei die DNA die Reihenfolge der Aminosäuren vorgibt. Die lineare Kette faltet sich durch chemische Wechselwirkungen in komplexe dreidimensionale Strukturen, die die Funktion des Proteins bestimmen. Jede Ebene der Proteinstruktur trägt zu Stabilität, Form und Funktion bei und zeigt, wie präzise der Körper diese Moleküle steuert, um lebenswichtige Aufgaben zu erfüllen.